![]()
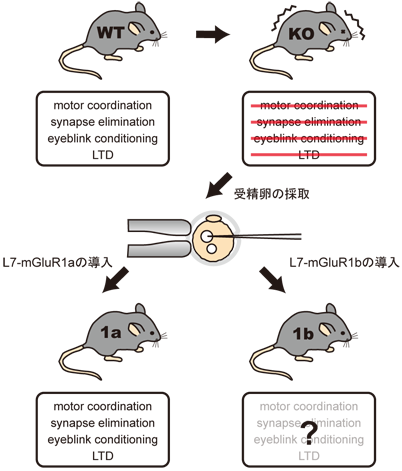
グルタミン酸は中枢神経系の主要な興奮性伝達物質であり、シナプス可塑性、記憶学習、細胞死等において中心的な役割を担っています。その受容体はGタンパク質と共役する代謝型グルタミン酸受容体 (mGluR)とイオンチャンネル型受容体 (iGluR)に大別されます。mGluRはこれまでに8種の遺伝子がクローニングされており、このうちmGluR1はmGluR5と共にグループIを形成し、Gqと共役しプロテインキナーゼC活性や細胞内カルシウム濃度を調節しています。 一方、mGluR1には長い細胞内C末端を持つaやそれを欠いた b, c等スプライシングの違いにより、複数のサブタイプがあることが知られています。mGluR1は小脳プルキンエ細胞・嗅球・視床・海馬等で強く発現しており、我々が行った欠損マウスの解析により、小脳長期抑圧(文献2)・海馬長期増強(文献1)等のシナプス可塑性に重要な働きをしていることが明らかとなりました。また、mGluR1欠損マウスで見られた、プルキンエ細胞に対する登上線維の多重支配(文献4)、平行線維-プルキンエ細胞シナプスでの長期抑圧、運動失調等がプルキンエ細胞特異的にmGluR1aを発現するマウス (mGluR1aレスキューマウス)では全て正常に戻っていることから、欠損マウスで見られたこれらの異常は全てプルキンエ細胞で発現するmGluR1の欠損によることが明らかとなりました(文献5)。一方、mGluR1aレスキューマウスでは、ノックアウトマウスで見られた運動失調、運動量の低下がレスキューされ、野生型マウスと同様の運動能力を持ちます。このマウスを用いて初めてmGluR1の小脳以外の機能を行動実験で検討する機会を得ました(文献8)。現在、このmGluR1分子を時期特異的に発現させることによって、運動学習、シナプス除去等でどの時期のmGluR1分子、もしくはそれを介した可塑性等が必須であるのかを検討しています。また、mGluR1と結合する蛋白質複合体の網羅的解析も進めており、個体レベルでのmGluR1依存性の現象がどのようなタンパク質群によって担われているかを検討しています(文献9)。
参考文献
1. Aiba et al., Cell, 79, 365-375 (1994)
2. Aiba et al., Cell, 79, 377-388 (1994)
3. Kano et al., Cell, 83, 1223-1231(1995)
4. Kano et al., Neuron, 18, 71-79 (1997)
5. Ichise et al., Science, 288, 1832-1835 (2000)
6. Maejima et al., Neuron, 31, 463-475 (2001)
7. Hashimoto et al., J. Neurosci., 21, 9701-9712 (2001)
8. Kishimoto et al., Eur. J. Neurosci., 16, 2416-2424 (2002)
9. Nakamura et al., Eur. J. Neurosci., 20, 2929-2944 (2004)
10. Ohtani et al.,
J. Neurosci., 34, 2072-2712 (2014)
11. Naito at al., Front. Mol. Neurosci., 11, 439 (2018)
12. Nakao et al., Sci. Rep., 9, 7353 (2019)
![]()
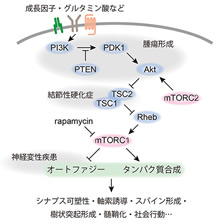
mTOR (mammalian target of rapamycin)は免疫抑制剤rapamycinの標的として同定された分子で、細胞のエネルギー代謝の中枢を担っています。mTORはmTORC1およびmTORC2と呼ばれる異なる2つのタンパク質複合体として機能し、mTORC1はアミノ酸や栄養因子などによって活性化し、タンパク質合成やオートファジーを通して細胞の成長や増殖を制御しています。mTORC1の働きの破綻は癌や糖尿病といった多くのヒトの疾患に関与しており、脳においては結節性硬化症・神経変性疾患など多様な神経疾患との関連が示唆されています。結節性硬化症は脳腫瘍・てんかん・自閉症などを発症する難病で、疾患の原因がmTORC1制御因子のTSC1/2の機能欠損変異であることから、mTORC1の恒常的な活性化が発症に結びついていると考えられています。また、神経変性疾患においてもmTORC1の異常な活性化が認められており、mTOR阻害剤のラパマイシンが治療薬として注目を集めています。
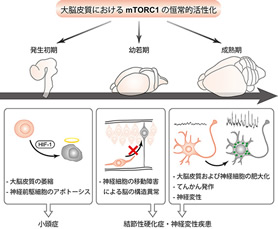
私たちはmTORC1が恒常的に活性化した遺伝子改変マウスを作製し、脳におけるmTORの機能や神経疾患との関連について研究しています。現在までに、胎生期の脳におけるmTORC1の活性化は小頭症を引き起こす一方で、成熟期の活性化は巨脳症やてんかん、神経変性疾患様の症状を発症することを発見しました。このことから、mTORC1 は脳の発達時期によって全く異なる役割を持つことが初めて明らかとなり、この違いがmTORC1活性の異常によって引き起こされる神経疾患の多様性の基盤となっていることが裏付けられました(文献1)。
参考文献
1. Kassai et al., Cell Rep., 7, 1626-1639 (2014)
2. Kanayama et al., Prostate, 77, 1489-1498 (2017)
3. Sakai et al., Sci. Rep., 9, 2799 (2019)
![]()
我々は、テトラサイクリン誘導システムを用い、発がん遺伝子であるポリオーマウイルスミドルT遺伝子とCreリコンビナーゼが同一の細胞で発現し、loxP の導入されている遺伝子の欠損とミドルTの発現による発がんが同時に生じるトランスジェニックマウスを作製しました。このトランスジーンをRacを始めとするloxP配列の導入された遺伝子を持つマウスに導入することにより、特定分子の発がんおよび転移浸潤における機能を個体レベルで明らかにすることができます。また、代謝型グルタミン酸受容体mGluR1をメラノサイトで発現するとメラノーマが100%形成されることが明らかにしました(文献1)。今後、グルタミン受容体依存的なメラノーマの形成の分子機構も解析予定です。
参考文献
1. Ohtani et al.,Oncogene, 27, 7162-7170 (2008)
![]()
Rac はRhoファミリーに属する低分子量Gタンパク質で細胞骨格の再構築に関与し、葉状仮足(lamellipodia)の形成や膜ラッフリングを誘導します。また、細胞-基質間接着(接着斑)の形成を促進することも報告されていますが、これらのRacの機能解析は、主に線維芽細胞を初めとする培養細胞に活性型 Rac、ドミナントネガティブRacをマイクロインジェクトしたり、それらのcDNAをトランスフェクトして得られた結果に基づいています。一方では、 Racは、Rasによって引き起こされる細胞のトランスフォーメンションにも必要であることが報告されていること、非浸潤性リンパ腫細胞を浸潤性に形質転換する遺伝子Tiam-1がRac特異的なGEF(グアンニンヌクレオチド交換因子)であること等から、Rac活性がヒトの発癌や、癌の転移や浸潤性に関与していることが予想されています。Rac1欠損マウスは、3胚葉形成時に外胚葉と内胚葉の間の部分に細胞死がおこり、欠損個体から単離した初代培養細胞では葉状仮足の形成がおこらず、細胞接着にも異常があります(文献1)。一方、Rac1欠損マウスは胎生8.5日までにすべて死亡してしまい、種々の臓器・器官でのRacの役割を検討するには部位特異的、空間特異的にRac1を欠損するマウスを作成、解析する必要があります。そこで我々は、Rac1をコンディショナルにノックアウトするマウスを作製しました。神経細胞特異的にRac1を欠損したマウスでは、Rac1を欠損した神経細胞のシナプス密度が有意に減少していることがわかり、シナプスの形成、維持にRac1が関与していることが明かにしました(未発表データ)。また皮膚特異的にRac1を欠損したマウスでは体毛の異常やメラニンの減少等が生じました(坂原ら、未発表データ)。
さらに、大脳皮質や海馬といった終脳領域でRac1をノックアウトしたマウスにおいては、左脳と右脳の大脳皮質を連絡する軸索である脳梁が欠損することを見出しました(文献2、下図1)。このことからRac1は神経ネットワークの形成に深く関与していることを示唆されます。現在、このようなRac の機能がどのような標的分子により担われているかを検討中です。
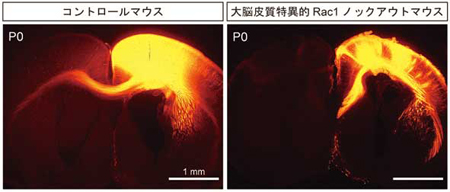
図1 大脳皮質および海馬においてRac1をノックアウトしたマウスの脳(生後0日齢)。右脳にDiIを注入し軸索を標識した結果、コントロールマウス(写真左)では、軸索が左脳にまで伸びているが、ノックアウトマウスにおいては正中付近でとまっています。
参考文献
1. Sugihara et al.,Oncogene, 17, 3427-3433 (1998)
2. Kassai et al., Eur. J. Neurosci., 28, 257-267 (2008)
![]()
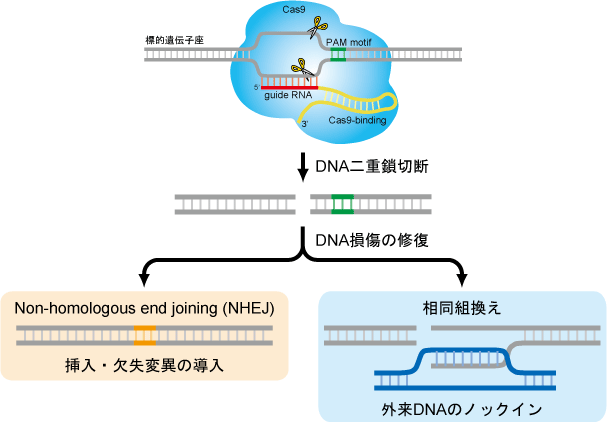
ゲノム編集は、人工ヌクレアーゼなどを用いたDNAの二重鎖切断とそれに伴う修復メカニズムに基づいて、ゲノムの標的部位に変異を導入する画期的な技術です。現在、代表的なシステムとして、ZFN・TALEN・CRISPR/Casが広く利用されています。とりわけCRISPR/Casシステムは非常に簡便かつ効率的にゲノムに変異を導入することができることから、ES細胞を用いたジーンターゲティング法に取って代わる次世代の変異動物作製技術として注目されています。当研究室ではこれらの技術を駆使して、変異マウス作製の効率化を図るとともに、新たな技術開発に取り組んでいます。
また、私たちは小型霊長類であるコモンマーモセットを対象として、神経科学に資するリソースや疾患モデルの開発に取り組んでいます。
参考文献
1. Nakao et al., Genesis, 54, 65-77 (2016)
2.
Saito et al., Transl. Psychiatry, 10, 35 (2020)